OBJETIVO
CLASE: Clasificará la
formación y propiedades de los compuestos con enlace iónico. Clasificará la
formación y propiedades de los compuestos con enlace.
ENLACE QUÍMICO: Corresponde a la fuerza que une
o enlaza a dos átomos, sean estos iguales o distintos.
De
acuerdo con la teoría de la formación de enlaces planteadas por los químicos,
veremos dos de las teorías más aceptadas y son:
- 1. La teoría del enlace de valencia: Solo los electrones del último orbital o electrones de valencia participan en la formación del enlace
- 2. La teoría del orbital molecular: Considera que los electrones de los átomos enlazados pertenecen a la molécula como un todo.
Cuando
los átomos se enlazan entre sí, ceden, aceptan o comparten electrones. Son los
electrones de valencia quienes determinan de qué forma se unirá un átomo con
otro y las características del enlace.
REGLA DEL OCTETO: Los elementos al combinarse unos con otros,
aceptan, ceden o comparten electrones con la finalidad de tener 8 electrones en
su nivel más externo.
Las
excepciones a la regla del octeto las podemos clasificar en dos grupos:
1) Octeto incompleto: cuando los átomos no
completan sus 8 electrones de valencia
- H2
- BeH2
- BH3
- AlCl3
- BF3
- Al I3
2) Octeto expandido: cuando los átomos
sobrepasan los 8 electrones de valencia
- PCl5
- SF6
- H2SO4
Los enlaces se pueden clasificar en
tres grupos principales: enlaces iónicos, enlaces covalentes y enlaces dativos. Los enlaces se
producen como resultado de los movimientos de los electrones de los átomos, sin
importar el tipo de enlace que se forme. Pero no cualquier electrón, puede
formar un enlace, sino solamente los electrones del último nivel energético
(más externo). A estos electrones se les llama electrones de valencia.
ENLACE IONICO: Se puede definir como la fuerza que
une a dos átomos a través de una cesión electrónica. Una cesión electrónica se
da cuando un elemento electropositivo se une con un elemento electronegativo.
Mientras mayor sea la diferencia de electronegatividad entre los elementos, más
fuerte será el enlace iónico. Se realiza una transferencia de uno o varios
electrones, la cual se hace desde el átomo de baja electronegatividad hasta el
de alta electronegatividad. Cada átomo
adquiere carga positiva (Baja electronegatividad, cede electrones) o negativa
(Alta electronegatividad, acepta electrones) estableciéndose una atracción
electrostática entre ellos; debido a esto también se le llama enlace electrovalente. Resumiendo, las
características de este enlace son:
- 1. Se realiza entre átomos que tienen gran electronegatividad
- 2. La transferencia de electrones se realiza del átomo de menor electronegatividad (generalmente es un metal) al átomo de mayor electronegatividad (generalmente es un no metal), por lo tanto está formado por un metal y un no metal.
Por
ejemplo, la sal de mesa está formada por los iones Na+ y Cl-. Si estudiamos su configuración electrónica,
tenemos que:
Na11=
1s2 2s2 2p62s1 Cl17=
1s2 2s2 2p63s2 3p5
|
|
ENLACE COVALENTE: Es aquel formado por la unión de
dos átomos con igual valor o poca diferencia de electronegatividad y que para
alcanzar el octeto comparten los electrones.
Este enlace ocurre entre no metales iguales o no metales diferentes. En el caso de los no metales iguales se
clasifica en:
-
Compuestos
covalente homonucleares, ejemplo: H2, F2, N2
|
|
|
|
|
|
- No
metales diferentes, ejemplo: CH4 y H2O
_
H
– O l
l
H
|
|
|
|
1.
Número de electrones compartidos:
-
Enlace
covalente sencillo si se comparten 2 electrones
-
Enlace
covalente doble si se comparten 4 electrones
-
Enlace
covalente triple si se comparten 4 electrones
2.
Diferencia de electronegatividades:
-
Enlace covalente polar: Si la diferencia de
electronegatividad es mayor a cero
- Enlace covalente no polar: Si la diferencia de electronegatividad
es igual a cero, en este caso los electrones del enlace permanecerán más tiempo
alrededor del átomo con mayor electronegatividad, originándose una carga
parcialmente negativa en el átomo con mayor electronegatividad y una carga
parcialmente positiva en el de menor electronegatividad.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.
Número de electrones aportados por
átomo:
-
Covalente
normal: Si los átomos aportan igual número de electrones
-
Covalente
coordinado o dativo: Si un átomo aporta electrones y el otro no
|
|
|
|
|
ENLACE METALICO: Enlace químico que mantiene unidos a
los átomos de forma muy cercana unos a otros de manera que forman estructuras
muy compactas. Estas estructuras forman
redes tridimensionales que adquieren la forma típica de empaquetamiento
compacto de esferas. Sus características son:
·
Suelen
ser sólidos a temperatura ambiente, excepto el mercurio
·
Presentan
brillo metálico
·
Son
dúctiles y maleables
·
Pueden
emitir electrones cuando reciben energía en forma de calor
MAR DE ELECTRONES: Los elementos con un
enlace metálico están compartiendo un gran número de electrones de valencia,
formando un mar de electrones rodeando un enrejado gigante de cationes. Según
este modelo, los átomos metálicos ceden sus electrones de valencia a una
"nube electrónica" que comprende todos los átomos del metal. Así
pues, el enlace metálico resulta de las atracciones electrostáticas entre los
restos positivos y los electrones móviles que pertenecen en su conjunto a la
red metálica. En el enlace metálico, los electrones no pertenecen a ningún
átomo determinado. Además, es un enlace no dirigido, porque la nube electrónica
es común a todos los restos atómicos que forman la red. Hay que aclarar que los
átomos cuando han cedido los electrones a la nube común, no son realmente
iones, ya que los electrones quedan dentro de la red, perteneciendo a todos los
"restos positivos". Este modelo es muy simple y sirve para
interpretar muchas de las propiedades de los metales; aunque tiene ciertas
limitaciones, principalmente en la explicación de la diferente conductividad de
algunos metales. Los
metales tienen puntos de fusión más altos por lo que se deduce que hay enlaces
más fuertes entre los distintos átomos. La vinculación metálica es no polar,
apenas hay (para los metales elementales puros) o muy poca (para las
aleaciones) diferencia de electronegatividad entre los átomos que participan en
la interacción de la vinculación, y los electrones implicados en que es la
interacción a través de la estructura cristalina del metal. El enlace metálico
explica muchas características físicas de metales, tales como fuerza,
maleabilidad, ductilidad, conducción del calor y de la electricidad, y lustre.
La vinculación metálica es la atracción electrostática entre los átomos del
metal o los iones y electrones deslocalizados. Esta es la razón por la cual se
explica un deslizamiento de capas, dando por resultado su característica
maleabilidad y ductilidad. Los átomos del metal tienen por lo menos un electrón
de la valencia, no comparten estos electrones con los átomos vecinos, ni
pierden electrones para formar los iones.
La
deslocalización electrónica, en física
y en química,
es el fenómeno que se produce cuando uno o varios electrones
pueden distribuirse o moverse entre varios centros (por ejemplo, átomos
en una molécula).
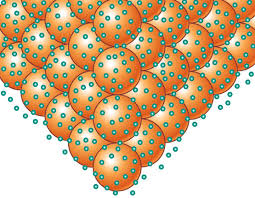
TEORIA DE BANDAS: Esta teoría representa un modelo más elaborado para explicar la formación del enlace metálico; se basa en la teoría de los orbitales moleculares. Esta teoría mantiene que cuando dos átomos se enlazan, los orbitales de la capa de valencia se combinan para formar dos orbitales nuevos que pertenecen a toda la molécula, uno que se denomina enlazante (de menor energía) y otro antienlazante (de mayor energía). Si se combinasen 3 átomos se formarían 3 orbitales moleculares, con una diferencia de energía entre ellos menor que en el caso anterior. En general, cuando se combinan N orbitales, de otros tantos átomos, se obtienen N orbitales moleculares de energía muy próxima entre sí, constituyendo lo que se llama una "banda". Bandas de energía:
- La banda de valencia (BV): está ocupada por los electrones de valencia de los átomos, es decir, aquellos electrones que se encuentran en la última capa o nivel energético de los átomos. Los electrones de valencia son los que forman los enlaces entre los átomos, pero no intervienen en la conducción eléctrica.
- La banda de conducción (BC): está ocupada por los electrones libres, es decir, aquellos que se han desligado de sus átomos y pueden moverse fácilmente. Estos electrones son los responsables de conducir la corriente eléctrica.
El
diagrama de niveles de energía, comprende una serie de bandas de energía en las
cuales pueden existir los electrones separados entre sí, por una zona llamada
banda prohibida. La cual recibe este nombre debido a que los electrones no
pueden tener los niveles de energía comprendidos dentro de los límites de esta
banda.
Los electrones comprendidos en la banda de valencia pueden ser llevados a la banda de conducción si se les confiere suficiente energía. Estos son llamados electrones libres considerando la cantidad de energía que hay que proporcionar a un electrón para que salga de la banda de valencia hacia la banda de conducción.
Los electrones comprendidos en la banda de valencia pueden ser llevados a la banda de conducción si se les confiere suficiente energía. Estos son llamados electrones libres considerando la cantidad de energía que hay que proporcionar a un electrón para que salga de la banda de valencia hacia la banda de conducción.
En
consecuencia, para que un material sea buen conductor de la corriente eléctrica
debe haber poca o ninguna separación entre la BC y la BV (que pueden a llegar a
solaparse), de manera que los electrones puedan saltar entre las bandas. Cuando
la separación entre bandas sea mayor, el material se comportará como un aislante. En ocasiones, la separación entre
bandas permite el salto entre las mismas de solo algunos electrones. En estos
casos, el material se comportará como un semiconductor. Para que el salto de
electrones entre bandas en este caso se produzca deben darse alguna o varias de
las siguientes situaciones: que el material se encuentre a altas presiones, a
una temperatura elevada o se le añadan impurezas (que aportan más electrones). Entre
la banda de valencia y la de conducción existe una zona denominada banda prohibida o gap, que separa ambas bandas y en la cual no pueden
encontrarse los electrones.
En
los metales, la banda de valencia
está llena o parcialmente llena; pero la diferencia energética entre la banda
de valencia y la de conducción es nula; es decir están solapadas. Por ello, si
la banda de valencia está total o parcialmente llena, los electrones pueden
moverse a lo largo de los orbitales vacios y conducir la corriente eléctrica al
aplicar una diferencia de potencial.
En los aislantes la banda de valencia está completa y
la de conducción vacía; pero a diferencia de los metales, no sólo no solapan
sino que además hay una importante diferencia de energía entre una y otra (hay
una zona prohibida) por lo que no pueden producirse saltos electrónicos.
En
los semiconductores la banda de valencia también está llena y hay una
separación entre las dos bandas, pero la zona prohibida no es tan grande,
energéticamente hablando, y algunos electrones pueden saltar a la banda de
conducción. Estos electrones y los huecos dejados en la banda de
valencia permiten que haya cierta conductividad eléctrica, la cual aumenta
con la temperatura, ya que se facilitan los saltos de los electrones a la banda
de conducción. Ejemplos: Ge, Si, GaAs y InSb.
ENLACES MOLECULARES: De acuerdo con la teoría de los orbitales moleculares, los enlaces covalentes de las moléculas se forman por solapamiento de orbitales atómicos, de manera que los nuevos orbitales moleculares pertenecen a la molécula entera y no a un solo átomo. Durante la formación de un enlace, los orbitales atómicos se acercan y comienzan a solaparse, liberando energía a medida que el electrón de cada átomo es atraído por la carga positiva del núcleo del otro átomo. Cuanto mayor sea el solapamiento, mayor será el desprendimiento de energía y, por lo tanto, menor será la energía del orbital molecular. Si el proceso de aproximación de los átomos continúa, los núcleos atómicos pueden llegar a repelerse mutuamente, lo que hace que la energía del sistema aumente. Esto significa que la máxima estabilidad (mínima energía) se alcanza cuando los núcleos se encuentran a una distancia determinada que se conoce como longitud de enlace.
FUERZAS DE VANDER WAALS: Es la fuerza atractiva o repulsiva
entre moléculas o entre partes de una misma
molécula. Cuando se encuentran a una distancia moderada, las moléculas se
atraen entre sí pero, cuando sus nubes electrónicas empiezan a
solaparse, las moléculas se repelen con fuerza. Las fuerzas de van der Waals
incluyen:
Fuerzas dipolo-dipolo (también llamadas fuerzas de Keesom): entre las que se incluyen los puentes de hidrógeno. Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva (Figura inferior izquierda). Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados
Fuerzas dipolo-dipolo inducido (también llamadas fuerzas de Debye): Tienen
lugar entre una molécula polar y una molécula apolar. En este caso, la carga de
una molécula polar provoca una distorsión en la nube electrónica de la molécula
apolar y la convierte, de modo transitorio, en un dipolo. En este momento se
establece una fuerza de atracción entre las moléculas. Gracias a esta
interacción, gases apolares como el O2, el N2 o el CO2 se pueden disolver en
agua.
Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London): Son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos. En promedio, la distribución de cargas en torno a una molecula apolar es simétrica y no hay momento dipolar.
Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London): Son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos. En promedio, la distribución de cargas en torno a una molecula apolar es simétrica y no hay momento dipolar.
ENLACE DE HIDROGENO: Es la fuerza atractiva entre un átomo electronegativo y un átomo de hidrógeno unido covalentemente a otro átomo
electronegativo, no se debe confundir con puente de hidrógeno.
PUENTE
DE HIDROGENO: Se refiere a una clase de enlace que se
produce a partir de la atracción existente en un átomo de hidrógeno y un átomo
de oxígeno, flúor o nitrógeno con carga negativa. Dicha atracción, por su
parte, se conoce como interacción dipolo-dipolo
y vincula el polo positivo de una molécula con el polo negativo de otra. El
átomo de hidrógeno, que cuenta con carga positiva, se conoce como átomo
donante, mientras que el átomo de oxígeno, fluor o nitrógeno es el átomo
aceptor del enlace. Los puentes de hidrógeno aparecen en el ADN, el agua y las proteínas,
por ejemplo. Debido a su existencia, se producen fenómenos de gran importancia,
que incluso aparecen de manera cotidiana. El punto de ebullición del agua,
la menor densidad del hielo respecto al agua líquida y la consistencia
de la glicerina están vinculados a la presencia de puentes de hidrógeno
en las moléculas.
ELECTROVALENCIA: Es el número de electrones ganados
o perdidos durante la formación de un enlace.
Tipos de valencia:
Valencia positiva máxima: Es el número positivo que refleja la máxima capacidad
de combinación de un átomo. Este número coincide con el Grupo de la Tabla
Periódica al cual pertenece. Por ejemplo: el Cloro (Cl) es del Grupo VIIA en la
tabla, por lo que su valencia positiva máxima es 7.
Valencia
negativa solo para el grupo A no para el grupo B: Es el número
negativo que refleja la capacidad que tiene un átomo de combinarse con otro
pero que esté actuando con valencia positiva. Este número negativo se puede
determinar contando lo que le falta a la valencia positiva máxima para llegar a
8, pero con signo -, por ejemplo: la valencia máxima positiva del átomo de
cloro es 7, por lo que le falta un electrón para cumplir el octeto, entonces su
valencia negativa será -1.
No hay comentarios.:
Publicar un comentario